Hannergrond a Studiendesign
Retatrutide (LY3437943) ass en neit Medikament mat engem eenzege Peptid, dat aktivéiertdräi Rezeptoren gläichzäitegGIP, GLP-1 a Glukagon. Fir seng Effizienz a Sécherheet bei Persoune mat Iwwergewiicht awer ouni Diabetis ze evaluéieren, gouf eng randomiséiert, duebelblann, Placebo-kontrolléiert Studie a Phase-2 duerchgefouert (NCT04881760). Insgesamt ...338 Participantenmat engem BMI ≥30 oder ≥27 mat op d'mannst enger gewichtsbedingter Komorbiditéit, goufen zoufälleg zougewisen, fir Placebo oder Retatrutid (1 mg, 4 mg mat zwou Titratiounspläng, 8 mg mat zwou Titratiounspläng oder 12 mg) eemol d'Woch duerch subkutan Injektioun fir 48 Wochen ze kréien.primären Endpunktwar déi prozentual Ännerung vum Kierpergewiicht no 24 Wochen, mat sekundären Endpunkten, déi d'Gewiichtsännerung no 48 Wochen a kategorial Gewiichtsverloschtschwellen (≥5%, ≥10%, ≥15%) enthalen hunn.
Schlësselresultater
-
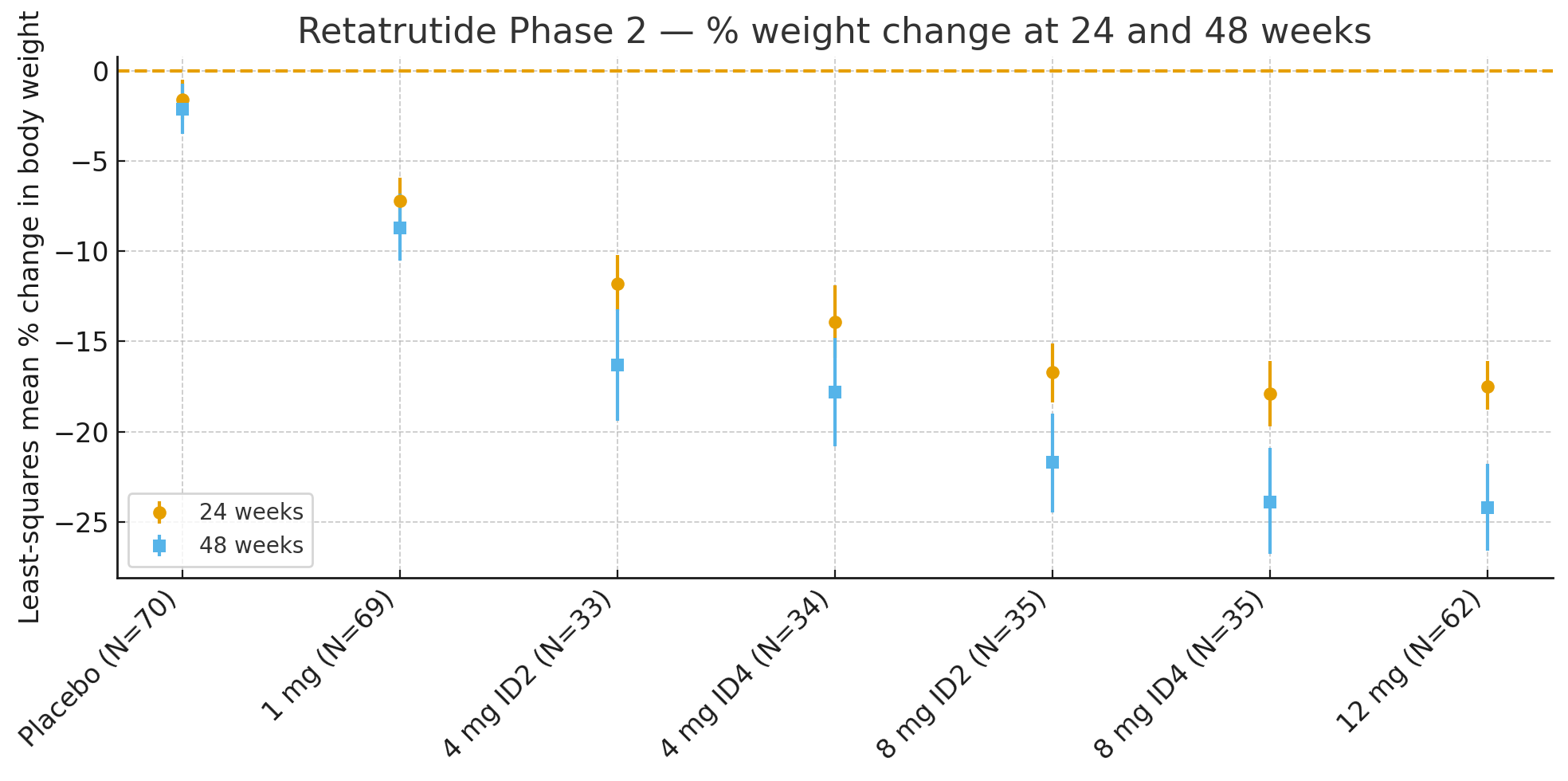
24 Wochen: Déi duerchschnëttlech Prozentsazännerung vum Kierpergewiicht am Verhältnes zum Ausgangswäert war de Klengste-Quadrat-Moyenne
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (kombinéiert): −12,9%
-
8 mg (kombinéiert): −17,3%
-
12 mg: −17,5%
-
-
48 WochenProzentsätzlech Ännerung vum Kierpergewiicht war
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (kombinéiert): −17,1%
-
8 mg (kombinéiert): −22,8%
-
12 mg: −24,2%
-
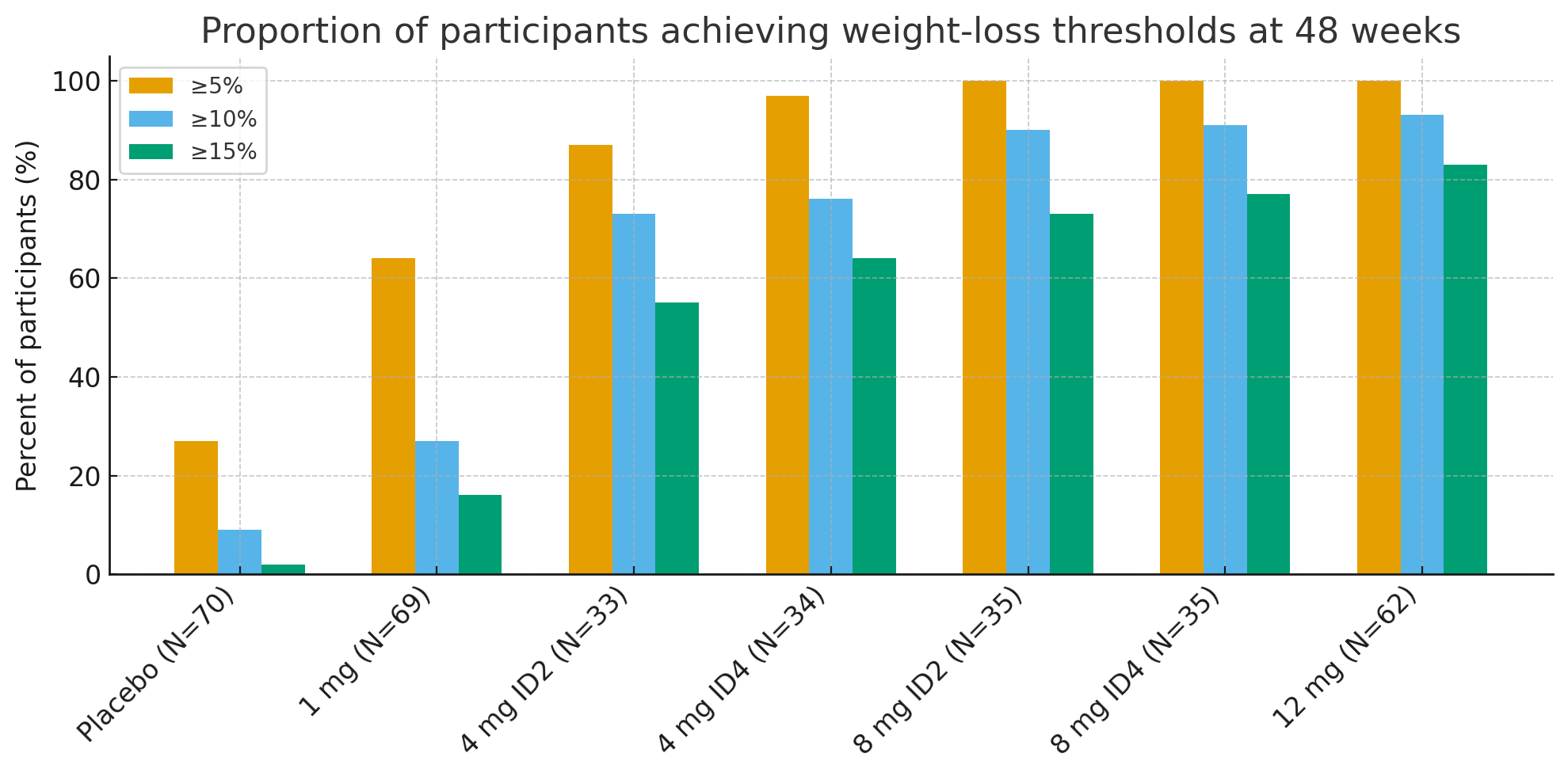
No 48 Wochen war d'Proportioun vun de Participanten, déi klinesch bedeitend Schwellen fir Gewiichtsverloscht erreecht hunn, opfälleg:
-
≥5% Gewiichtsverloscht: 27% mat Placebo vs. 92–100% an aktiven Gruppen
-
≥10%: 9% mat Placebo vs. 73–93% an aktiven Gruppen
-
≥15%: 2% mat Placebo vs. 55–83% an aktiven Gruppen
An der 12 mg Grupp, bis zu26% vun de Participanten hunn ≥30% vun hirem Basisgewiicht verluer, eng Gréisstenuerdnung vum Gewiichtsverloscht, déi mat bariatrescher Chirurgie vergläichbar ass.
Sécherheet
Déi heefegst Nebenwirkungen ware gastrointestinal (Iwwelzegkeet, Erbrechung, Duerchfall), meeschtens liicht bis mëttelméisseg an dosisofhängeg. Méi niddreg Ufanksdosen (Titratioun vun 2 mg) hunn dës Evenementer reduzéiert. Dosisofhängeg Erhéijunge vun der Häerzfrequenz goufen observéiert, mat engem Héichpunkt an der 24. Woch an duerno engem Réckgang. D'Ofsetzungsraten louchen tëscht 6–16% an de verschiddene Gruppen, eppes méi héich wéi bei Placebo.
Conclusiounen
Bei Erwuessenen mat Iwwergewiicht ouni Diabetis gouf wöchentlech subkutan Retatrutid fir 48 Wochen produzéiertsubstantiell, dosisofhängeg Reduktioun vum Kierpergewiicht(bis zu ~24% duerchschnëttleche Verloscht bei der héchster Dosis), zesumme mat Verbesserunge vun de kardiometabolesche Marker. Gastrointestinal Nebenwirkungen waren heefeg, awer mat Titratioun behandelbar. Dës Phase-2-Resultater suggeréieren, datt Retatrutid e neien therapeutesche Benchmark fir Iwwergewiicht kéint duerstellen, ofhängeg vun der Bestätegung a gréisseren, laangfristege Phase-3-Studien.
Zäitpunkt vun der Verëffentlechung: 28. September 2025